Уикипедия:Медицина/Translation/Lung cancer
Предлага се тази статия да се обедини със страницата Рак на белия дроб. |
| Рак на белите дробове | |
 Изображение рентгенова снимка на гръден кош, показваща тумор в белия дроб (маркиран със стрелка) | |
| Класификация и външни ресурси | |
|---|---|
| База данни DiseasesDB | 7616 |
| База данни MedlinePlus | 007194 |
| База данни eMedicine | med/1333 med/1336 emerg/335 radio/807 radio/405radio/406 |
| Мед. рубрики MeSH | D002283 |
Ракът на белите дробове е заболяване, което се характеризира с неконтролиран растеж на клетките в тъканите на белия дроб. Ако се остави без лечение, този растеж може да се разпространи извън белия дроб в процес, наречен метастаза, в близките тъкани или други части от тялото. Повечето ракови заболявания, които започват в белия дроб, известни като първични ракови заболявания на белия дроб, са карциноми, образувани от епителни клетки. Основните видове рак на белия дроб са дребноклетъчен белодробен карцином (ДКБК), тип "овесено зърно", и недребноклетъчен белодробен карцином (НДКБК). Най-честите симптоми са кашлица (включително кървави храчки), загуба на телесно тегло и задух.
Най-честата причина за рак на белите дробове е продължителната експозиция на тютюнев дим, която е причина за 80–90% от случаите на рак на белите дробове. Около 10–15% от случаите на рак на белите дробове се срещат при непушачи, като тези случаи често се приписват на комбинация от генетични фактори, газ радон, азбест и замърсяване на въздуха, включително пасивно пушене. Ракът на белите дробове може да се види на изображения от рентгенография на гръдния кош и компютърна томография (КТ). Диагнозата се потвърждава с биопсия[1], която обикновено се прави с бронхоскопия или наблюдение с КТ. Лечението и дългосрочните последици зависят от вида на рака, стадия (степента на разсейване) и цялостното здравословно състояние на пациента, измерено чрез функционалния статус.
Най-честите методи на лечение са хирургия, химиотерапия и радиотерапия. НДКБК понякога се лекува хирургически, докато ДКБК обикновено се повлиява по-добре от химиотерапия и радиотерапия.[2] Средно 15% от пациентите в Съединените щати, диагностицирани с рак на белите дробове оцеляват пет години след диагнозата. В световен мащаб ракът на белите дробове е най-честата причина за смъртни случаи, свързани с рак при мъжете и жените и е отговорен за 1,38 милиона смъртни случая всяка година, по данни от 2008 г.[3]
Признаци и симптоми
[редактиране на кода]Признаците и симптомите, които предполагат рак на белите дробове, включват:
- симптоми на дихателната система: кашлица, кървави храчки, хриптене или задух
- системни симптоми: загуба на телесно тегло, висока температура, заобляне на ноктите на пръстите или умора
- симптоми, дължащи се на локален натиск: болка в гърдите, болки в костите, обструкция на горна вена кава, затруднено преглъщане
Ако ракът нарасне в дихателните пътища, той може да наруши потока от въздух и така да причини затруднено дишане. Обструкцията може да доведе до натрупване на секрети зад блокираната част, които да предразположат към пневмония.
В зависимост от вида на тумора, така наречената паранеопластична проява може първоначално да привлече вниманието към заболяването. При рак на белия дроб тези прояви може да включват миастенен синдром на Ламберт-Итън (слабост в мускулите поради автоантитела), хиперкалцемия или синдром на неадекватна секреция на антидиуретичен хормон (SIADH). Туморите в областта на белодробния връх, известни като тумори на Панкост могат да засегнат локалната част на симпатичната нервна система и да доведат до синдром на Хорнер (увисване на клепача и стеснена зеница от засегнатата страна), както и увреждане на брахиалния плексус.
Много от симптомите на рак на белия дроб (понижен апетит, загуба на телесно тегло, повишена температура, умора) не са специфични.[1] При много хора ракът вече се е разпространил извън първоначалното огнище преди да се появят симптомите и да потърсят медицинска помощ. Най-честите места на разпространение включват мозъка, костите, надбъбречните жлези, другия бял дроб, черния дроб, перикарда и бъбреците. Около 10% от пациентите с рак на белия дроб нямат симптоми по време на диагнозата. Такива случаи на рак са открити случайно при рутинна радиография на гръдния кош.
Причини
[редактиране на кода]Ракът се развива вследствие на генетично увреждане на ДНК. Това генетично увреждане засяга нормалните функции на клетката, включително клетъчна пролиферация, програмирана клетъчна смърт (апоптоза) и възстановяване на ДНК. С натрупване на уврежданията рискът от рак се увеличава.[4]
Тютюнопушене
[редактиране на кода]
Пушенето, по-специално на цигари, е най-основният фактор, допринасящ за рак на белия дроб. Цигареният дим съдържа над 60 известни канцерогена, включително радиоизотопи от последователността на разпадане на радон, нитрозамин и бензопирен. Освен това никотинът потиска имунната реакция към растежа на раковите клетки в изложената тъкан. В развитите държави 90% от смъртните случаи на рак на белите дробове при мъжете през 2000 г. се дължат на тютюнопушене (70% при жените). Тютюнопушенето е причина за 80–90% от случаите на рак на белия дроб.
Пасивното пушене — вдишването на дима, издишван от пушачите, е причина за рак на белите дробове при непушачи. Пасивен пушач означава човек, който живее или работи с пушач. Изследвания от САЩ,[5][6]Европа,[7] Великобритания[8] и Австралия постоянно показват значително увеличен риск при хората, изложени на пасивно пушене.[9] При хора живеещи с пушач съществува 20–30% по-висок риск, докато при тези, които работят в среда с издишан дим от пушачи, рискът се увеличава с 16–19%.[10] Изследванията върху вдишания дим от пушачи сочат, че той е дори по-опасен от прекия дим, вдишван от пушачите. Пасивното пушене причинява около 3 400 случая на смърт от рак на белия дроб в САЩ всяка година.[6]
Радон
[редактиране на кода]Радонът е безцветен газ, без мирис, генериран от разпада на радиоактивен радий, който от своя страна е продукт от разпадането на урана, който се намира в земната кора. Продуктите от радиационен разпад йонизират генетичния материал, като по този начин причиняват мутации, които понякога се превръщат в ракови. Радонът е втората по честота причина за рак на белия дроб в САЩ след тютюнопушенето.[6] Рискът се увеличава с 8–16% на всеки 100 Bq/m³, увеличени в концентрацията на радон.[11]Нивата на радон варират по местоположение и състав на основните почви и скали. Например в райони като Корнуол във Великобритания (където има гранит като подслой), радонът е основен проблем и сградите трябва да бъдат силно вентилирани, за да се намалят концентрациите на радон. Агенцията за опазване на околната среда на САЩ (EPA) изчислява, че в един на всеки 15 домове в САЩ нивата на радон са над препоръчителната концентрация от 4 пикокюри на литър (pCi/l) (148 Bq/m³).
Азбест
[редактиране на кода]Азбестът може да причини различни белодробни заболявания, включително рак на белия дроб. Тютюнопушенето и азбестът имат синергичен ефект върху образуването на рак на белия дроб. Азбестът може също да причини рак на плеврата, наричан мезотелиом (който е различен от рака на белия дроб).[12]
Замърсяване на въздуха
[редактиране на кода]Външното замърсяване на въздуха има незначителен ефект върху увеличаването на риска от рак на белия дроб.[13] Фините прахови частици (ФПЧ2,5) и сулфатните аерозоли, които се отделят с отработените газове от движението, се свързват с леко увеличен риск.[14] При азотния двуокис увеличение със стъпка от 10 части на милиард увеличава риска от рак на белия дроб с 14%.[15] Изчислено е, че външното замърсяване на въздуха допринася за 1–2% от случаите на рак на белия дроб.[13]
Прогнозните доказателства подкрепят тезата за увеличен риск от рак на белия дроб от замърсяване на въздуха в закрити помещения, свързан с горенето на дърва, въглища, тор или остатъци от реколта за готвене и отопление.[16] Жените изложени на дим от въглища в закрити помещения са с около два пъти по-висок риск, а страничните продукти от изгарянето на биомаса са известни или предполагаеми канцерогени.[17] Този риск засяга около 2,4 милиарда души в целия свят[16] и се счита, че допринася за 1,5% от смъртните случаи от рак на белия дроб.[17]
Генетика
[редактиране на кода]Изчислено е, че 8 до 14% от случаите на рак на белия дроб се дължат на наследствени фактори.[18] При роднините на хора, страдащи от рак на белия дроб, рискът се увеличава 2,4 пъти. Това вероятно се дължи на комбинация от гени.[19]
Други причини
[редактиране на кода]Многобройни други вещества, професии и влиянието на околната среда се свързват с рака на белите дробове. Международната агенция за изследване на рака (МАИР) констатира, че има достатъчно доказателства за канцерогенността в белия дроб на следните:[20]
- Някои метали (производството на алуминий, кадмий и кадмиеви съединения, хром(VI) съединения, берилий и съединения на берилия, железни и стоманени сплави, никелови съединения, арсен и неорганични съединения на арсена, подземния добив на хематит)
- Някои продукти на горенето (непълно изгаряне, въглища (емисии на закрито от изгарянето на битови въглища), газификация на въглища, смола от каменовъглен катран, производство на кокс, сажди, отработени газове на дизелов двигател)
- Йонизиращо лъчение (Рентгеново лъчение, радон-222 и продуктите на разпада му, гама-лъчение, плутоний)
- Някои от токсичните газове (метилов етер (техническо качество), Бис-(хлорометил) етер, серен иприт, МОПП (смес от винкристин-преднизон-азот мустард-прокарбазин), изпарения от бои)
- Производство на каучук и кристален кварцов прах
Патогенеза
[редактиране на кода]Подобно на много други видове рак, ракът на белия дроб започва с активиране на онкогените или с деактивирането на туморсупресорни гени. Cчита се, че онкогените правят хората по-податливи на рак. Протоонкогените се превръщат в онкогени, когато са изложени на влиянието на определени карциногени. Мутациите на K-ras протоонкогените са причина за 10–30% от белодробните аденокарциноми. Рецепторът на епидермалния растежен фактор (РЕРФ) регулира клетъчната пролиферация, апоптозата, ангиогенезата и туморната инвазия. Мутациите и засилването на РЕРФ са чести при недребноклетъчния рак на белия дроб и предоставят основа за лечение с РЕРФ инхибитори. Her2/neu е по-рядко засегнат. Хромозомно увреждане може да доведе до загуба на хетерозиготността. Това може да предизвика деактивация на туморсупресорните гени. Увреждания на хромозомите 3P, 5q, 13q и 17p са особено чести при дребноклетъчен белодробен карцином. Туморсупресорния ген p53, разположен в хромозом 17p, е засегнат в 60-75% от случаите. Други гени, които често мутират или се увеличават са c-MET, NKX2-1,LKB1, PIK3CA и BRAF.
Диагноза
[редактиране на кода]
Рентгенография на гръдния кош е една от първите изследвания, които се провеждат, ако дадено лице съобщи симптоми, които може да пораждат съмнение за рак на белия дроб. Възможно е да се открие явно образувание, разширяване на средостението (предполагащо разпространение до намиращи се там лимфни възли), ателектаза (колапс), консолидация (пневмония) или плеврална ефузия. За да се получи повече информация за вида и степента на заболяването, се прави КТ-сканиране (компютърно томографско сканиране). Бронхоскопия или КТ-биопсия биопсия често се прилагат за вземане на проби от тумора за хистопатология.
Ракът на белия дроб често се вижда като единичен белодробен възел на рентгеновата снимка на гръдния кош. Въпреки това диференциалната диагноза е обширна. Много други болести изглеждат по същия начин, включително туберкулозата, гъбичните инфекции, метастазирал рак или организирана пневмония. По-рядко срещани причини за единичен белодробен възел са хематоми, бронхогенни кисти, аденоми, артериовенозни малформации, белодробна секвестрация, ревматоидни възли, вегенерова грануломатоза или лимфома.[21] Ракът на белите дробове може също да бъде инцидентно открит, като единичен белодробен възел видим на изображение от рентгенография на гръдния кош или КТ-сканиране, направено по различна причина.[22] Окончателната диагноза на рак на белия дроб се основава на хистологично изследване на съмнителната тъкан в контекста на клиничните и рентгенологични особености.
Класификация
[редактиране на кода]| Хистологичен вид | Заболеваемост на 100 000 души на година |
|---|---|
| Всички видове | 66,9 |
| Аденокарцином | 22,1 |
| Плоскоклетъчен карцином | 14,4 |
| Дребноклетъчен карцином | 9,8 |
Белодробният рак се класифицира според хистологичния вид.[1] Тази класификация е важна за определяне на лечението и за прогностициране на развитието на заболяването. По-голямата част от случаите на белодробен рак са карциноми — злокачествени заболявания, чийто произход е от епителни клетки. Карциномите на белия дроб се категоризират според размера и вида на злокачествените клетки, които се наблюдават от хистопатолог под микроскоп. Двата основни класа са недребноклетъчен и дребноклетъчен белодробен карцином.[23]
Недребноклетъчен карцином
[редактиране на кода]
Трите основни подвида на недребноклетъчни карциноми са аденокарцином, плоскоклетъчен белодробен карцином и едроклетъчен белодробен карцином.
Близо 40% от случаите на рак на белия дроб са аденокарцином, който обикновено е с произход от периферната белодробна тъкан.[1] Повечето случаи на аденокарцином са свързани с тютюнопушене. Въпреки това сред хората, които са пушили по-малко от 100 цигари в живота си ("непушачи"), аденокарциномът е най-честата форма на рак на белия дроб.[24] Един подвид на аденокарциномa, бронхоалвеоларният карцином, е по-често срещан при жени, които са непушачки и при тях може да има по-добра дългосрочна преживяемост.
Плоскоклетъчният карцином е причинител на около 30% от рака на белите дробове. Типично се появява в близост до големи дихателни пътища. Празната кухина и асоциираната с нея клетъчна смърт често се срещат в центъра на тумора.[1] Около 9% от случаите на рак на белия дроб са едроклетъчни карциноми. Те се наричат така, защото раковите клетки са големи, с излишък на цитоплазма, големи нуклеи и очевидно нуклеоли.[1]
Дребноклетъчен белодробен карцином
[редактиране на кода]
В случаите на дребноклетъчен белодробен карцином (ДКБК) клетките съдържат плътни невросекреторни гранули везикули, съдържащи невроендокринни хормони), които свързват този тумор с ендокринен / паранеопластичен синдром. Повечето случаи възникват в големите дихателни пътища (първични и вторични бронхи). Тези ракови образувания нарастват бързо и се разпространяват в началото на развитието на болестта. Шестдесет до седемдесет процента от пациентите имат метастатично заболяване при представянето. Този тип на рак на белия дроб е силно свързан с тютюнопушенето.
Други
[редактиране на кода]Признати са четири основни хистологични подвида, въпреки че някои видове рак могат да съдържат комбинация от различни подвидове.[23] Редките подвидове включват: тумори на жлезите, карциноидни тумори и недиференцирани карциноми.
Mетастази
[редактиране на кода]| Хистологичен вид | Имунохистохимия |
|---|---|
| Плоскоклетъчен карцином | CK5/6 позитивен CK7 негативен |
| Аденокарцином | CK7 позитивен TTF-1 позитивен |
| Едроклетъчен карцином | TTF-1 негативен |
| Дребноклетъчен карцином | TTF-1 позитивен CD56 позитивен Хромогранин позитивен Синаптофизин позитивен |
Белият дроб е обичайно място за разпространение на тумори от други части на тялото. Вторичните тумори се класифицират според мястото на произхода им, напр. рак на гърдата, който се е разпространил в белия дроб, се нарича метастатичен рак на гърдата. Метастазите често имат характерно окръглено изображение при рентгенография на гръдния кош.
Самият белодробен рак най-често метастазира към мозъка, костите, черния дроб и надбъбречните жлези.[1] Имунохистохимията на биопсичен материал често помага да се установи източникът.[25]
Стадии
[редактиране на кода]Определянето на стадиите на рака на белия дроб представлява оценка на степента на разпространение на рака от оригиналния му източник. Той е един от факторите, които повлияват прогнозирането и потенциалното лечение на рака на белия дроб.
Първоначалната оценка на стадиите на недребноклетъчния белодробен карцином (НДКБК) използва TNM-класификация (TNM – тумор, нодул, метастаза). Тя се основава на размера на първичния тумор, наличие на усложнение на лимфен нодул (възел) и формирани метастази. След това, с помощта на TNM дефинициите, се определя група, варираща от окултен рак, през стадии 0, IA (едно-A), IB, IIA, IIB, IIIA, IIIB и IV (четири). Това групиране по стади помага при избора на лечение и оценка на прогнозата.[26]
Дребноклетъчния белодробен карцином (ДКБК) традиционно се класифицира като "ограничен стадий" (ограничен до половината на гръдния кош и в рамките на едно приемливо поле на радиотерапия) или “екстензивен стадий” (по-широко разпространено заболяване). Въпреки това TNM-класификацията и групирането са полезни за преценката на прогнозата.[26]
За НДКБК и ДКБК двата основни типа стадийни оценки са клинично стадиране и хирургическо стадиране. Клинично стадиране се извършва преди решаващата хирургия. То се основава на резултатите от образни изследвания (като КТ-сканиране и ПЕТ сканиране) и резултатите от биопсията. Хирургическото стадиране се установява по време на или след операцията и се основава на комбинираните резултати от хирургическите и клиничните данни, включително хирургическите проби от торакални лимфни възли.[1]
Превенция
[редактиране на кода]Превенцията е икономически най-ефикасното средство за намаляване разпространението на рака на белите дробове. Докато в повечето страни промишлените и битовите канцерогени са идентифицирани и са забранени, тютюнопушенето все още е широко разпространено. Премахването на тютюнопушенето е основна цел в превенцията на рака на белия дроб, като спирането на тютюнопушенето е важно превантивно средство в този процес.[27]
Политиките за намаляване на пасивното пушене на обществени места, като ресторанти и работни места, са все по-популярни в много западни страни.[28]В Бутан от 2005 г. вече има въведена пълна забрана на тютюнопушенето, а Индия е въвела забрана на пушенето на публични места от октомври 2008 г. [29]Световната здравна организация призова правителствата да въведат пълна забрана на рекламата на тютюневи изделия и да предотвратят започването на пушене сред младите хора. Изчислено е, че подобни забрани са намалили потреблението на тютюн с 16% в страните, в които са въведени.[30]
Продължителната употреба на витамин A,[31][32] витамин C,[31] витамин D[33] или витамин E[31] не намалява риска от белодробен рак. Някои проучвания показват, че хората, чиято диета включва по-голям дял зеленчуци и плодове, са по-малко застрашени,[6][34] но това вероятно се дължи на объркване. По-подробните проучвания не показват ясна връзка.[34]
Скрининг
[редактиране на кода]Скринингът представлява провеждане на медицински изследвания за откриване на заболяване при безсимптомни хора. Възможните скринингови изследвания за рак на белия дроб включват цитология на храчки, радиография на гръден кош (РГК) и компютърна томография (КТ). Скрининговите програми, използващи РГК или цитология не са доказали, че са от полза.[35] Ежегодният скрининг с нискодозова КТ на хора с повишен риск (напр. на възраст между 55 и 79, които са пушили повече от 30 пакетогодини или онези, които вече са имали белодробен рак, може да намали опасността от смърт поради белодробен рак с абсолютна стойност от 0,3% (относителна стойност от 20%).[36][37] Въпреки това съществува голям брой фалшиво положителни тестове, в резултат на които може да се стигне до ненужни инвазивни процедури, както и до значителни финансови разходи.[38] На всеки действително положителен тест се падат повече от 19 фалшиво положителни.[39] Излагането на радиация е друга потенциална опасност при скрининга.[40]
Лечение
[редактиране на кода]Лечението на белодробния рак зависи от специфичния клетъчен тип на рака, доколко се е разпространил и от общото състояниена пациента. Общоприетото лечение включва палиативни грижи,[41] хирургия, химиотерапия и радиационна терапия.
Хирургия
[редактиране на кода]
Ако изследванията потвърдят НДКБК, определянето на стадия е необходимо, за да се уточни дали заболяването е локализирано и подлежи на операция, или се е разпространило дотолкова, че не може да се лекува по хирургически път. За това определяне се използват CT сканиране и позитронна емисионна томография. Ако има подозрения за включен медиастенален лимфен възел, може да се използва медфиастеноскопия за проба от възлите и подпомагане на определянето на стадия.[42] Кръвните изследвания и изследването на пулмоналната функция се използват за да се определи дали състоянието на пациента е достатъчно добро за хирургична операция. Ако изследването на пулмоналната функция покаже недостатъчни дихателни резерви, хирургичната операция може да не е подходяща опция.
В повечето случаи на НДКБК в ранен стадий изборът на лечение е хирургическо отстраняване на лоба на белия дроб (лобектомия). При хора, чието състояние не е подходящо за пълна лобектомия, може да бъде извършена по-малка сублобарна резекция (клиновидна резекция). При клиновидната резекция обаче съществува по-висок риск от рецидив, отколкото при лобектомията.[43] Радиоактивната йодна брахитерапия на границите на участъка на клиновидна резекция може да намали опасността от рецидив.[44]По-рядко се извършва отстраняване на целия бял дроб (пневмоектомия).[43] Видеоасистираната торакоскопична хирургия и ВАТХ лобектомията използват минимално инвазивния подход при хирургическите операции на белодробен рак.[45] ВАТХ лобектомията е еднакво ефективна с конвенционалната отворена лобектомия, с по-малко следоперативни усложнения.[46]
При ДКБК (дребноклетъчен белодробен карцином) обикновено се използват химиотерапия и/или лъчетерапия.[47] Въпреки това ролята на хирургията при ДКБК беше преосмислена. Хирургическото лечение може да подобри резултатите, ако се добави към химиотерапията и облъчването в ранния стадий на ДКБК.[48]
Лъчетерапия
[редактиране на кода]Лъчетерапията често се прилага заедно с химиотерапия и може да се използва с лечебна цел при хора с НДКБК, които не са подходящи за операция. Тази форма на високоинтензивна лъчетерапия се нарича радикална лъчетерапия. Усъвършенствана форма на тази техника е непрекъснатата хиперфракционирана ускорена лъчетерапия (англ. CHART).[49] По принцип следоперативната лъчетерапия на гръден кош не трябва да се използва след лечебна хирургическа операция за НДКБК. Някои пациенти с включен N2 медиастинален лимфен възел могат да се повлияят положително от следоперативна лъчетерапия.[50]
При потенциално лечими случаи на ДКБК лъчетерапия на гръден кош често се препоръчва допълнително към химиотерапията.[1]
Ако растежът на карцинома блокира малък участък от бронхите, може да се приложи брахитерапия (локализирана лъчетерапия) директно в дихателните пътища, за да се отвори пасажът.[51]В сравнение с външната лъчетерапия, брахитерапията позволява съкращаване на времето за лечение и по-малко излагане на здравния персонал на въздействието на радиацията.[52]
Профилактичното краниално облъчване (ПКО) е вид лъчетерапия на мозъка, който се използва за намаляване на риска от метастази. ПКО е от най-голяма полза при ДКБК. При ограничен стадий на болестта ПКО увеличава тригодишната преживяемост от 15% до 20%, а при напреднало заболяване едногодишната преживяемост се повишава от 13% на 27%.[53]
Последните подобрения в прицелна и образната терапия доведоха до разработването на метод със стереотактична радиация за лечение на ранен стадий на рак на белия дроб. При тази форма на лъчетерапия чрез малък брой сесии се прилагат високи дози, като при използват стереотактични прицелни техники. Използва се предимно при пациенти, които не са пригодни за хирургично лечение, поради съпътстващи заболявания.[54]
Както при пациентите с ДКБК, така и при тези с НДКБК за контрол на симптомите върху гръдния кош може да се приложат по-малки дози радиация (палиативна лъчетерапия).[55]
Химиотерапия
[редактиране на кода]Режимът на химиотерапия зависи от вида на тумора.[1] Дребноклетъчният белодробен карцином (ДКБК), дори и в сравнително ранен стадий на заболяването, се третира предимно с химиотерапия и облъчване.[56] При ДКБК най-често се използват цисплатин и етопозид. Използват се също комбинации с карбоплатин, гемцитабин, паклитаксел, винорелбин, топотекан и иринотекан. При напреднал недребноклетъчен белодробен карцином (НДКБК) химиотерапията увеличава преживяемостта и се използва като първа линия терапия, при условие че състоянието на пациента позволява лечение.[57] Обикновено се използват два медикамента, единият от които е на базата на платина (или цисплатина иликарбоплатина). Други често използвани медикаменти са гемцитабин, паклитаксел, доцетаксел,[58] пеметрексед,[59] етопозид и винорелбин.
Адювантната химиотерапия в случая е употребата на химиотерапия след частична лечебна хирургия за подобряване на резултата. При НДКБК по време на операцията се вземат проби от близките лимфни възли за определянето на стадия. Ако се потвърди стадий II или III, адювантната химиотерапия увеличава преживяемостта с 5% до пет години.[60][61] Комбинацията от винорелбин и цисплатина е по-ефикасна от останалите режими.[61] Ползата от адювантна химиотерапия за хора със стадий IB е противоречива, тъй като клиничните изследвания не са демонстрирали ясно подобряване на преживяемостта. Проучванията за предопреативна химиотерапия (неоадювантна химиотерапия) при операбилен НДКБК са неубедителни.
Палиативни грижи
[редактиране на кода]При хора с терминално заболяване може да са необходими палиативни грижи или хоспис. Тези подходи позволяват допълнително обсъждане на опциите за лечение и дават възможност за постигане на добре обмислени решения[62][63] и може да са от полза за избягване на безполезни, но скъпо струващи грижи в края на живота.[63]
Химиотерапията може да се комбинира с палиативни грижи при лечението на НДКБК. В напреднали случаи подходящата химиотерапия подобрява средната преживяемост, както и качеството на живот.[64] При добра физическа форма поддържащата химиотерапия по време на палиативния период на рак на белия дроб може да способства за 1,5 до 3 месеца удължаване на преживяемостта, облекчаване на симптомите и подобряване на качеството на живот с по-добри резултати, наблюдавани при лечение със съвременни лекарствени средства. [65][66] Групата за мета-анализ на НДКБК препоръчва, ако пациентът желае и може да изтърпи лечение, при напреднал НДКБК да се включи химиотерапия.[57][67]
Прогноза
[редактиране на кода]| Клиничен стадий | Петгодишна преживяемост (%) | |
|---|---|---|
| Недребноклетъчен белодробен карцином | Дребноклетъчен белодробен карцином | |
| IA | 50 | 38 |
| IB | 47 | 21 |
| IIA | 36 | 38 |
| IIB | 26 | 18 |
| IIIA | 19 | 13 |
| IIIB | 7 | 9 |
| IV | 2 | 1 |
Прогнозата обикновено е лоша. От всички хора с белодробен рак 15 % преживяват пет години след поставяне на диагнозата. По време на поставянето на диагнозата стадият често е напреднал. При представянето пред лекаря 30-40% от случаите на НДКБК и 60% от ДКБК са в стадий IV.[1]
Прогностичните фактори при НДКБК включват наличие или липса на дихателни симптоми, размер на тумора, тип клетки (хистология), степен на разпространение (стадий) и метастази към лимфните възли и съдова инвазия. При хората с непозволяващо операция заболяване прогнозите са по-лоши при тези на болните с незадоволен физиологичен статус и повече от 10% загуба на телесно тегло.
Non-Small Cell Lung Cancer Treatment // PDQ for Health Professionals. National Cancer Institute. Посетен на 2008-11-22.</ref> Прогностичните фактори при дребноклетъчния белодробен карцином включват общо състояние, пол, стадий на заболяването и това дали към момента на поставяне на диагнозата са засегнати централната нервна система или черния дроб.
Най-добрата прогноза при НДКБК се постига с пълно хирургично отстраняване при заболяване в стадий IA с до 70% петгодишна преживяемост.[68] Общата петгодишна преживяемост при ДКБК е около 5%. Хората с напреднал стадий на ДКБК имат средна петгодишна преживяемост от по-малко от 1%. Средното време на преживяемост при ограничен стадий на болестта е 20 месеца с петгодишна преживяемост от 20%.
По данни от Националния онкологичен институт средната възраст при диагностициране на рак на белия дроб в Съединените щати е 70 години,[69] а средната възраст при настъпване на смъртта е 72 години.[70] В САЩ хората със здравна застраховка имат по-голям шанс за по-добра прогноза.[71]
Епидемиология
[редактиране на кода]
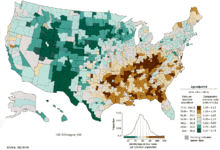
Ракът на белия дроб е най-разпространеният рак по целия свят по отношение на два фактора - честота и смъртност. През 2008 г. е имало 1,61 нови случая и 1,38 смъртни случая поради рак на белия дроб. Най-високи са нивата в Европа и Северна Америка.[3] Дялът от населението, който е под най-голям риск да развие белодробен рак, включва хората над 50 години, които изобщо някога са пушили. За разлика от смъртността при мъжете, която започна да намалява преди повече от 20 години, нивата на смъртност от белодробен рак при жените се повишиха през последните десетилетия и едва сега започват да се стабилизират. В САЩ пожизненият риск от развиване на белодробен рак е 8% при мъжете и 6% при жените.
На всеки 3-4 милиона изпушени цигари се пада един случай на смърт от белодробен рак.[72] Влиянието на "тютюневите гиганти" играе решителна роля за културата на пушене. Младите непушачи, които гледат реклами на цигари са с по-голяма вероятност да започнат да пушат.[73] Ролята на пасивното пушене все повече се признава за рисков фактор за белодробен рак,[9] водещ до политическа намеса за намаляване на нежеланото излагане на непушачите на влиянието на тютюневия дим от пушачи.[74] Емисиите от автомобилите, заводите и електроцентралите също представляват потенциална опасност.[13]
Източна Европа е с най-висока смъртност от белодробен рак сред мъжете, докато северна Европа и САЩ са с най-висока смъртност сред жените. В Съединените щати чернокожите мъже и жени са с по-висока честота на заболеваемост.[75] Процентните дялове на белодробен рак в момента са по-ниски в развиващите се страни. С увеличаване на пушенето в развиващите се страни се очаква и нарастване на нивата през следващите няколко години, особено в Китай.[76] and India.
От 1960-те години нивата на белодробния аденокарцином започнаха да нарастват в сравнение с тези на другите видове белодробен рак. Това е така отчасти поради въвеждането на цигари с филтър. Използването на филтър отстранява по-едрите частици от тютюневия дим, като така намалява попадането им в големите дихателни пътища. Въпреки това на пушача се налага да вдишва по-дълбоко, за да получи същото количество никотин, като по този начин се увеличава попадането на частиците в малките дихателни пътища, където има тенденция за възникване на аденокарцином. Честотата на белодробен аденокарцином продължава да нараства.[77]
История
[редактиране на кода]Белодробният рак е бил необичаен преди появата на пушенето на цигари. Той дори не е бил признат за отделно обособена болест до 1761 г. Различни аспекти на белодробния рак са описани по-късно през 1810 г. Злокачествените белодробни тумори представлявали само 1% от всички видове рак, установявани при аутопсия през 1878 г., но броят на случаите се увеличил до 10-15% в първите години след 1900 г. Съобщения за случаи в медицинската литература посочват само 374 по целия свят през 1912 г., но преглед на аутопсиите показва, че честотата на белодробния рак се е увеличила от 0,3% през 1852 г. до 5,66% през 1952 г. В Германия през 1929 г. лекарят Фриц Ликинт разпознава връзката между пушенето и белодробния рак, което довежда до агресивна кампания против пушенето. Изследвания на британските лекари, публикувани през 1950-те, е първото солидно епидемиологично доказателство за връзката между белодробния рак и пушенето. Като резултат през 1964 г. Службата по здравеопазване на Съединените щати препоръчва на пушачите да спрат пушенето.
Връзката с радона е установена за първи път сред миньорите в Ерцгебирге, близо до Шнееберг, Саксония. Там от 1470 г. се добива сребро, а тези мини са богати на уран, с придружаващия го радий и газ радон. Миньорите развивали непропорционален брой белодробни заболявания, евентуално идентифицирани като белодробен рак през 1870 г.[78] Въпреки това откритие разработването на мините продължило до 1950-те, поради търсенето на уран от страна на СССР. Радонът е признат за причинител на белодробен рак през 1960-те.[79]
Първата пневмонектомия за белодробен рак е извършена през 1933 г. Палиативната лъчетерапия се използва от 1940-те. Радикалната лъчетерапия, използвана обикновено през 1950-те, е опит за използване на по-големи дози радиация при пациенти в сравнително ранен стадий на белодробен рак, но неподходящи за хирургична операция по друга причина. През 1997 г. непрекъснатата хиперфракционирана ускорена лъчетерапия е открита като подобрение на конвенционалната радикална лъчетерапия. При дребноклетъчния белодробен карцином първоначалните опити през 1960-те за хирургическа резекция и радикална лъчетерапия са неуспешни. През 1970-те са разработени успешни режими с химиотерапия.
Източници
[редактиране на кода]- ↑ а б в г д е ж з и к л Lu, C и др. 78: Cancer of the Lung // Holland-Frei Cancer Medicine. 8th. People's Medical Publishing House, 2010. ISBN 9781607950141.
- ↑ Chapman, S и др. Chapter 31 // Oxford Handbook of Respiratory Medicine. 2nd. Oxford University Press, 2009. ISBN 9-780199-545162.
- ↑ а б Ferlay, J и др. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008 // International Journal of Cancer 127 (12). December 2010. DOI:10.1002/ijc.25516. с. 2893–2917.
- ↑ Brown, KM и др. 8 // Holland-Frei Cancer Medicine. 8th. People's Medical Publishing House USA, 2010. ISBN 978-1607950141.
- ↑ California Environmental Protection Agency. Health effects of exposure to environmental tobacco smoke. California Environmental Protection Agency // Tobacco Control 6 (4). 1997. DOI:10.1136/tc.6.4.346. с. 346–353.
* CDC. State-specific prevalence of current cigarette smoking among adults, and policies and attitudes about secondhand smoke—United States, 2000 // Morbidity and Mortality Weekly Report 50 (49). Atlanta, Georgia, CDC, December 2001. с. 1101–1106. - ↑ а б в г Alberg, AJ и др. Epidemiology of lung cancer // Chest 132 (S3). American College of Chest Physicians, September 2007. DOI:10.1378/chest.07-1347. с. 29S–55S.
- ↑ Jaakkola, MS и др. Impact of smoke-free workplace legislation on exposures and health: possibilities for prevention // European Respiratory Journal 28 (2). August 2006. DOI:10.1183/09031936.06.00001306. с. 397–408.
- ↑ Parkin, DM. Tobacco—attributable cancer burden in the UK in 2010 // British Journal of Cancer 105 (Suppl. 2). December 2011. DOI:10.1038/bjc.2011.475. с. S6–S13.
- ↑ а б Taylor, R и др. Meta-analysis of studies of passive smoking and lung cancer: effects of study type and continent // International Journal of Epidemiology 36 (5). October 2007. DOI:10.1093/ije/dym158. с. 1048–1059.
- ↑ Frequently asked questions about second hand smoke // World Health Organization. Посетен на 25 July 2012.
- ↑ Schmid K, Kuwert T, Drexler H. Radon in Indoor Spaces: An Underestimated Risk Factor for Lung Cancer in Environmental Medicine // Dtsch Arztebl Int 107 (11). March 2010. DOI:10.3238/arztebl.2010.0181. с. 181–6.
- ↑ Davies, RJO и др. 18.19.3 // Oxford Textbook Medicine. 5th. OUP Oxford, 2010. ISBN 978-0199204854.
- ↑ а б в г Alberg AJ, Samet JM. Chapter 46 // Murray & Nadel's Textbook of Respiratory Medicine. 5th. Saunders Elsevier, 2010. ISBN 978-1-4160-4710-0.
- ↑ Chen, H и др. A systematic review of the relation between long-term exposure to ambient air pollution and chronic diseases // Reviews on Environmental Health 23 (4). Oct-Dec 2008. с. 243–297.
- ↑ Clapp, RW и др. Environmental and Occupational Causes of Cancer New Evidence, 2005–2007 // Reviews on Environmental Health 23 (1). Jan-Mar 2008. с. 1–37.
- ↑ а б Lim, WY и др. Biomass fuels and lung cancer. // Respirology (Carlton, Vic.) 17 (1). 2012 Jan. с. 20-31.
- ↑ а б Sood, A. Indoor fuel exposure and the lung in both developing and developed countries: an update. // Clinics in chest medicine 33 (4). 2012 Dec. с. 649-65.
- ↑ Dudley, Joel. Exploring Personal Genomics. Oxford University Press, 2013. ISBN 9780199644483. с. 25.
- ↑ Kern JA, McLennan G. Fishman's Pulmonary Diseases and Disorders. 4th. McGraw-Hill, 2008. ISBN 0-07-145739-9. с. 1802.
- ↑ Cogliano, VJ и др. Preventable exposures associated with human cancers. // Journal of the National Cancer Institute 103 (24). 2011 Dec 21. с. 1827-39.
- ↑ Miller, WT. Fishman's Pulmonary Diseases and Disorders. 4th. McGraw-Hill, 2008. ISBN 0-07-145739-9. с. 486.
- ↑ Kaiser, LR. Fishman's Pulmonary Diseases and Disorders. 4th. McGraw-Hill, 2008. ISBN 0-07-145739-9. с. 1815–1816.
- ↑ а б Maitra, A и др. Robbins Basic Pathology. 8th. Saunders Elsevier, 2007. ISBN 978-1-4160-2973-1. с. 528–529.
- ↑ Subramanian, J и др. Lung cancer in never smokers: a review // Journal of Clinical Oncology 25 (5). American Society of Clinical Oncology, February 2007. DOI:10.1200/JCO.2006.06.8015. с. 561–570.
- ↑ Tan D, Zander DS. Immunohistochemistry for Assessment of Pulmonary and Pleural Neoplasms: A Review and Update // Int J Clin Exp Pathol 1 (1). 2008. с. 19–31.
- ↑ а б в Rami-Porta, R и др. The revised TNM staging system for lung cancer // Annals of Thoracic and Cardiovascular Surgery 15 (1). February 2009. с. 4–9.
- ↑ Goodman, GE. Lung cancer. 1: prevention of lung cancer // Thorax 57 (11). November 2002. с. 994–999.
- ↑ McNabola, A и др. The control of environmental tobacco smoke: a policy review // International Journal of Environmental Research and Public Health 6 (2). February 2009. DOI:10.3390/ijerph6020741. с. 741–758.
- ↑ Pandey, G. Indian ban on smoking in public // BBC, 2 October 2008. Посетен на 2012-04-25.
- ↑ UN health agency calls for total ban on tobacco advertising to protect young // United Nations News service, 30 May 2008.
- ↑ а б в Fabricius, P и др. Diet and lung cancer // Monaldi Archives for Chest Disease 59 (3). July–September 2003. с. 207–211.
- ↑ Fritz, H и др. Vitamin A and Retinoid Derivatives for Lung Cancer: A Systematic Review and Meta Analysis // PLoS ONE 6 (6). 2011. DOI:10.1371/journal.pone.0021107. с. e21107.
- ↑ Herr, C и др. The role of vitamin D in pulmonary disease: COPD, asthma, infection, and cancer // Respiratory Research 12 (1). March 2011. DOI:10.1186/1465-9921-12-31. с. 31.
- ↑ а б Key, TJ. Fruit and vegetables and cancer risk // British Journal of Cancer 104 (1). January 2011. DOI:10.1038/sj.bjc.6606032. с. 6–11.
- ↑ Manser, RL и др. Screening for lung cancer // Cochrane Database of Systematic Reviews (1). 2004. DOI:10.1002/14651858.CD001991.pub2. с. CD001991.
- ↑ Jaklitsch, MT и др. The American Association for Thoracic Surgery guidelines for lung cancer screening using low-dose computed tomography scans for lung cancer survivors and other high-risk groups // Journal of Thoracic and Cardiovascular Surgery 144 (1). July 2012. DOI:10.1016/j.jtcvs.2012.05.060. с. 33–38.
- ↑ Bach, PB и др. Benefits and harms of CT screening for lung cancer: a systematic review // JAMA: the Journal of the American Medical Association 307 (22). June 2012. DOI:10.1001/jama.2012.5521. с. 2418–2429.
- ↑ Boiselle, PM. Computed tomography screening for lung cancer. // JAMA : the journal of the American Medical Association 309 (11). 2013 Mar 20. с. 1163-70.
- ↑ Bach PB, Mirkin JN, Oliver TK, et al. Benefits and harms of CT screening for lung cancer: a systematic review // JAMA 307 (22). June 2012. DOI:10.1001/jama.2012.5521. с. 2418–29.
- ↑ Aberle, DR и др. Computed tomography screening for lung cancer: has it finally arrived? Implications of the national lung screening trial. // Journal of clinical oncology : official journal of the American Society of Clinical Oncology 31 (8). 2013 Mar 10. с. 1002-8.
- ↑ Ferrell, B и др. Palliative care in lung cancer // Surgical Clinics of North America 91 (2). April 2011. DOI:10.1016/j.suc.2010.12.003. с. 403–417.
- ↑ Kaiser LR. Fishman's Pulmonary Diseases and Disorders. 4th. McGraw-Hill, 2008. ISBN 0-07-145739-9. с. 1853–1854.
- ↑ а б Kaiser LR. Fishman's Pulmonary Diseases and Disorders. 4th. McGraw-Hill, 2008. ISBN 0-07-145739-9. с. 1855–1856.
- ↑ Odell, DD и др. Sublobar resection with brachytherapy mesh for stage I non-small cell lung cancer // Seminars in Thoracic and Cardiovascular Surgery 22 (1). Spring 2010. DOI:10.1053/j.semtcvs.2010.04.003. с. 32–37.
- ↑ Alam, N и др. Video-assisted thoracic surgery (VATS) lobectomy: the evidence base // Journal of the Society of Laparoendoscopic Surgeons 11 (3). July–September 2007. с. 368–374.
- ↑ Rueth, NM и др. Is VATS lobectomy better: perioperatively, biologically and oncologically? // Annals of Thoracic Surgery 89 (6). June 2010. DOI:10.1016/j.athoracsur.2010.03.020. с. S2107–S2111.
- ↑ Simon GR, Turrisi A. Management of small cell lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition) // Chest 132 (3 Suppl). September 2007. DOI:10.1378/chest.07-1385. с. 324S–339S.
- ↑ Goldstein, SD и др. Role of surgery in small cell lung cancer // Surgical Oncology Clinics of North America 20 (4). October 2011. DOI:10.1016/j.soc.2011.08.001. с. 769–777.
- ↑ Hatton, MQ и др. Continuous hyperfractionated accelerated radiotherapy (CHART) and non-conventionally fractionated radiotherapy in the treatment of non-small cell lung cancer: a review and consideration of future directions // Clinical Oncology (Royal College of Radiologists) 22 (5). June 2010. DOI:10.1016/j.clon.2010.03.010. с. 356–364.
- ↑ Le Péchoux, C. Role of postoperative radiotherapy in resected non-small cell lung cancer: a reassessment based on new data // Oncologist 16 (5). 2011. DOI:10.1634/theoncologist.2010-0150. с. 672–681.
- ↑ Cardona, AF и др. Palliative endobronchial brachytherapy for non-small cell lung cancer // Cochrane Database of Systematic Reviews (2). April 2008. DOI:10.1002/14651858.CD004284.pub2. с. CD004284.
- ↑ Ikushima, H. Radiation therapy: state of the art and the future // Journal of Medical Investigation 57 (1–2). February 2010. с. 1–11.
- ↑ Paumier, A и др. Prophylactic cranial irradiation in lung cancer // Cancer Treatment Reviews 37 (4). June 2011. DOI:10.1016/j.ctrv.2010.08.009. с. 261–265.
- ↑ Girard, N и др. Stereotactic radiotherapy for non-small cell lung cancer: From concept to clinical reality. 2011 update // Cancer Radiothérapie 15 (6–7). October 2011. DOI:10.1016/j.canrad.2011.07.241. с. 522–526.
- ↑ Fairchild, A и др. Palliative thoracic radiotherapy for lung cancer: a systematic review // Journal of Clinical Oncology 26 (24). August 2008. DOI:10.1200/JCO.2007.15.3312. с. 4001–4011.
- ↑ Hann CL, Rudin CM. Management of small-cell lung cancer: incremental changes but hope for the future // Oncology (Williston Park) 22 (13). 2008-11-30. с. 1486–92.
- ↑ а б Chemotherapy in Addition to Supportive Care Improves Survival in Advanced Non–Small-Cell Lung Cancer: A Systematic Review and Meta-Analysis of Individual Patient Data From 16 Randomized Controlled Trials // J. Clin. Oncol. 26 (28). October 2008. DOI:10.1200/JCO.2008.17.7162. с. 4617–25.
- ↑ Mehra R, Treat J. Fishman's Pulmonary Diseases and Disorders. 4th. McGraw-Hill, 2008. ISBN 0-07-145739-9. с. 1876.
- ↑ Fuld AD, Dragnev KH, Rigas JR. Pemetrexed in advanced non-small-cell lung cancer // Expert Opin Pharmacother 11 (8). June 2010. DOI:10.1517/14656566.2010.482560. с. 1387–402.
- ↑ Carbone, DP и др. Adjuvant therapy in non-small cell lung cancer: future treatment prospects and paradigms // Clinical Lung Cancer 12 (5). September 2011. DOI:10.1016/j.cllc.2011.06.002. с. 261–271.
- ↑ а б Le Chevalier, T. Adjuvant chemotherapy for resectable non-small-cell lung cancer: where is it going? // Annals of Oncology 21 (Suppl. 7). October 2010. DOI:10.1093/annonc/mdq376. с. vii196–198.
- ↑ Kelley AS, Meier DE. Palliative care—a shifting paradigm // New England Journal of Medicine 363 (8). August 2010. DOI:10.1056/NEJMe1004139. с. 781–2.
- ↑ а б Prince-Paul M. When hospice is the best option: an opportunity to redefine goals // Oncology (Williston Park, N.Y.) 23 (4 Suppl Nurse Ed). April 2009. с. 13–7.
- ↑ Souquet PJ, Chauvin F, Boissel JP, Bernard JP. Meta-analysis of randomised trials of systemic chemotherapy versus supportive treatment in non-resectable non-small cell lung cancer // Lung Cancer 12 Suppl 1. April 1995. DOI:10.1016/0169-5002(95)00430-9. с. S147–54.
- ↑ Sörenson S, Glimelius B, Nygren P. A systematic overview of chemotherapy effects in non-small cell lung cancer // Acta Oncol 40 (2–3). 2001. с. 327–39.
- ↑ Clegg A, Scott DA, Sidhu M, Hewitson P, Waugh N. A rapid and systematic review of the clinical effectiveness and cost-effectiveness of paclitaxel, docetaxel, gemcitabine and vinorelbine in non-small-cell lung cancer // Health Technol Assess 5 (32). 2001. с. 1–195.
- ↑ Шаблон:Cite Cochrane
- ↑ Spiro, SG. 18.19.1 // Oxford Textbook Medicine. 5th. OUP Oxford, 2010. ISBN 978-0199204854.
- ↑ SEER data (SEER.cancer.gov)Median Age of Cancer Patients at Diagnosis 2002-2003
- ↑ SEER data (SEER.cancer.gov)Median Age of Cancer Patients at Death 2002-2006
- ↑ Slatore, CG и др. An official American Thoracic Society systematic review: insurance status and disparities in lung cancer practices and outcomes // American Journal of Respiratory and Critical Care Medicine 182 (9). November 2010. DOI:10.1164/rccm.2009-038ST. с. 1195–1205.
- ↑ Proctor, RN. The history of the discovery of the cigarette-lung cancer link: evidentiary traditions, corporate denial, global toll // Tobacco Control 21 (2). March 2012. DOI:10.1136/tobaccocontrol-2011-050338. с. 87–91.
- ↑ Lovato, C и др. Impact of tobacco advertising and promotion on increasing adolescent smoking behaviours // Cochrane Database of Systematic Reviews (10). October 2011. DOI:10.1002/14651858.CD003439.pub2. с. CD003439.
- ↑ Kemp, FB. Smoke free policies in Europe. An overview // Pneumologia 58 (3). Jul–Sep 2009. с. 155–158.
- ↑ National Cancer Institute; SEER stat fact sheets: Lung and Bronchus. Surveillance Epidemiology and End Results. 2010[1]
- ↑ Zhang, J и др. Tobacco smoking in China: prevalence, disease burden, challenges and future strategies // Respirology 16 (8). November 2011. DOI:10.1111/j.1440-1843.2011.02062.x. с. 1165–1172.
- ↑ Kadara, H и др. Pulmonary adenocarcinoma: a renewed entity in 2011 // Respirology 17 (1). January 2012. DOI:10.1111/j.1440-1843.2011.02095.x. с. 50–65.
- ↑ Greenberg, M и др. Lung cancer in the Schneeberg mines: a reappraisal of the data reported by Harting and Hesse in 1879 // Annals of Occupational Hygiene 37 (1). February 1993. с. 5–14.
- ↑ Samet, JM. Radiation and cancer risk: a continuing challenge for epidemiologists // Environmental Health 10 (Suppl. 1). April 2011. DOI:10.1186/1476-069X-10-S1-S4. с. S4.
Външни препратки
[редактиране на кода]...........
