Уикипедия:Мистификации и шеги/Флуорохелиева киселина
За тази статия беше установено, че е мистификация и по тази причина беше изтрита от основното именно пространство. Запазването ѝ на служебна подстраница в Уикипедия се прави само с цел информиране на читателската аудитория в случай, че мистификацията се е разпространила и на външни за Уикипедия сайтове и миръри. |
| Мистификации и шеги/Флуорохелиева киселина | |||||

 Електронен облак на флуорохелиева киселина | |||||
| Имена | |||||
|---|---|---|---|---|---|
| По IUPAC | Флуорооксохелиева(II) киселина Водороден флуорооксохелиат(II) | ||||
| Други | Флухелова киселина Водороден флуорохелиат Водороден флухелат Флуорохелиева вода Флухелова вода Флуорооксохелиева вода Флуорохелиатна вода Флухелатна вода Флуорооксохелиатна вода Флуорохелиатен лед Флухелатен лед Флуорооксохелиатен лед Флуорохелиев лед Флухелов лед Флуорооксохелиев лед Флуорохелиит Флухелит Флуорооксохелиит | ||||
| Структура | |||||
| Молекулна форма | линия (хелий) ъгъл (кислород) | ||||
| Свойства | |||||
| Формула | HOHeF | ||||
| Моларна маса | 50 g/mol | ||||
| Външен вид | безцветна течност | ||||
| Точка на топене | −0,25 °C | ||||
| Точка на кипене | 120 °C | ||||
| Критична температура | 150 °C | ||||
| Критично налягане | 120 bar | ||||
| Разтворимост във вода | ∞ | ||||
| Разтворимост в етанол | реагира продукт: етилфлуорохелиат | ||||
| Разтворимост в ацетон | реагира продукт: 2-флуорохелиато-2-пропанол | ||||
| pKa | 0,0000000054 | ||||
| Опасности | |||||
| ЕС класификация | |||||
| Основни опасности | разяждащ, запалим, експлозив | ||||
| Фрази за риск | R35, R50/53, R2 | ||||
| Фрази за безопасност | S1/2, S15, S16, S17 | ||||
| NFPA 704 |
| ||||
| Точка на запалване | 125 °C | ||||
| Контакт с очите | увреждане | ||||
| Контакт с кожата | изгаряне | ||||
| Сродни съединения | |||||
| Сродни аниони | тиофлуорохелиева киселина, пероксифлуорохелиева киселина | ||||
| Сродни катиони | флуоронеонова киселина, флуороаргонова киселина | ||||
| Сродни силни киселини | азотна киселина, сярна киселина, карборанова киселина | ||||
| Други | хелиев хидрофлуорид | ||||
| Идентификатори | |||||
| SMILES | HOHeF | ||||
| Данните са при стандартно състояние на материалите (25 °C, 100 kPa), освен ако не е указано друго. | |||||
Флуорохелиевата киселина, наричана така флухелова киселина, е много силна минерална оксокиселина (свръхкиселина). Анхидрид се нарича бис(флуорохелиил)оксид. Солите и естерите са флуорохелиати.
Физични свойства
[редактиране на кода]Представлява безцветна течност. Втвърдената флуорохелиева киселина е кристално вещество и се нарича флуорохелиатен лед. Другата форма на втвръдена флуорохелиева киселина е полимерна. Разтваря се във вода, етанол, ацетон, хлороформ, дисерен дихлорид, тетрахлорометан, бензен, серовъглерод и др. Разтваря мазнини, белтъци, въглехидрати, сапуни, пластмаси, стъкло, хартия и много др. вещества. Не разтваря тефлон. Не се съхранява в стъклени съдове.
Химични свойства
[редактиране на кода]Може да си образува олигомери.
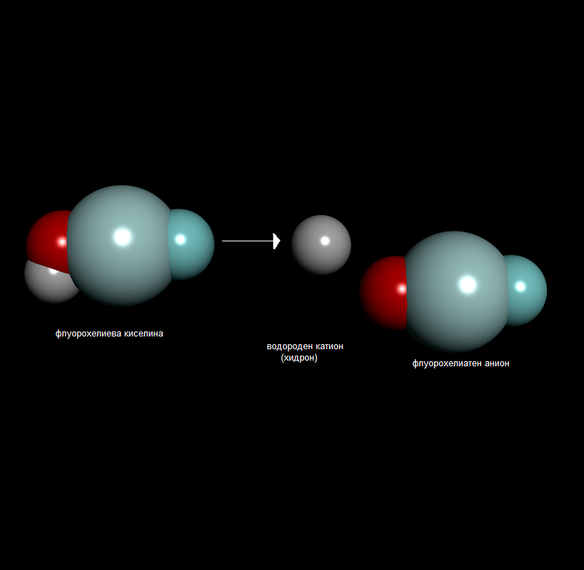
Дисоциира се във вода на водородни катиони и флуорохелиатни аниони.
- HOHeF → H+ + OHeF-
Има варианти на дисоциацията:
- 2HOHeF → H+ + H(OHeF)2-
- 2HOHeF → H2OHeF+ + OHeF-
- 3HOHeF → H+ + H2(OHeF)3-
- 3HOHeF → H3OHeF2+ + 2OHeF-
- 3HOHeF → H2OHeF+ + H(OHeF)2-
- 4HOHeF → H2OHeF+ + H2(OHeF)3-
- 5HOHeF → H3OHeF2+ + 2H(OHeF)2-
- 7HOHeF → H3OHeF2+ + 2H2(OHeF)3-
При първи етап при нагряване водата от флуорохелиевата киселина изпарява и се получава бис(флуорохелиил)оксид, защото има много силно окислително действие. При втори етап бис(флуорохелиил)оксидът се разлага на хелий и кислороден дифлуорид. При трети етап кислородният дифлуорид се разлага с взрив на атомен кислород и флуор.
І етап: 2HOHeF → H2O + O(HeF)2
ІІ етап: O(HeF)2 → 2He + OF2
ІІІ етап: OF2 → O + F2
Сумарно уравнение: 2HOHeF → H2O + 2He + O + F2

Поглъща влагата от въздуха и от навлажнени предмети.

Разтворът е силно киселинен. Флуорохелиевата киселина е по-силна от карборанова киселина и е по-слаба от флуоронеонова киселина, флуороаргонова киселина, флуорохипокриптониста киселина, флуорохипоксенониста киселина и флуорохипорадониста киселина. Киселинноста може да се докаже с лакмус, универсален индикатор или фенолфталеин. Лакмусът и универсалният индикатор променят цвета си в червено, а фенолфталеинът - оранжево.
Взаимодейства се с метали без отделяне на водород, а с отделяне на вода и хелиев хидрофлуорид. Взаимодейства още с метални оксиди и хидроксиди, соли (хлориди, сулфиди, селениди, телуриди, полониди и т.н.), алкохоли, етери, алдехиди, кетони, карбоксилни киселини, естери, хемиацетали, хемикетали, ацетали, кетали и много др. Ако флуорохелиевата киселина е в излишък, получават се кисели соли, наречени хидрогенбис(флуорохелиати), дихидрогентрис(флуорохелиати) или киселини.
Напр.: Взаимодействие със сребро, получава се сребърен флуорохелиат:
- 2Ag + 3HOHeF → 2AgOHeF + H2O + HHeF↑
Напр.: Взаимодействие със сребро, ако флуорохелиевата киселина е в излизък, получава се сребърен хидрогенбис(флуорохелиат), сребърен дихидрогентрис(флуорохелиат) или водороден бис(флуорохелиато)аргентат:
- 2Ag + 5HOHeF → 2Ag[H(OHeF)2] + H2O + HHeF↑
- 2Ag + 7HOHeF → 2Ag[H2(OHeF)3] + H2O + HHeF↑
- 2Ag + 5HOHeF → 2H[Ag(OHeF)2] + H2O + HHeF↑
Напр.: Взаимодействие с меден оксид, получава се меден бис(флуорохелиат):
- CuO + 2HOHeF → Cu(OHeF)2 + H2O
Напр.: Взаимодействие с натриев хидроксид, получава се натриев флуорохелиат:
- NaOH + HOHeF → NaOHeF + H2O
Напр.: Взаимодействие с железен бис(флуорохелиат), получава се тетраводороден хексакис(флуорохелиато)ферат:
- Fe(OHeF)2 + 4HOHeF → H4[Fe(OHeF)6]
Напр.: Взаймодействие с железен сулфид, получава се железен бис(флуорохелиат) с отделяне на сероводород, който е силно отровен газ, защото този опит се провежда в камина:
- FeS + 2HOHeF → Fe(OHeF)2 + H2S↑
Напр.: Взаймодействие с етанол, получава се етилфлуорохелиат:
- C2H5OH + HOHeF → C2H5OHeF + H2O
Напр.: Взаимодействие с тетрахидрофуран без отделяне на хелиев хидрофлуорид, получава се 4-флуорохелиато-1-бутанол:
- C4H8O + HOHeF → FHeOC4H8OH
Напр.: Взаимодействие с целулоза, получава се трис(флуорохелиато)целулоза
Добиване, разпространение и значение
[редактиране на кода]Флуорохелиевата киселина и техните соли и естери не се срещат в природата заради голямата сила на киселината.

Флуорохелиевата киселина се намира в очите на хистериите от Аурелия. Натриевият флуорохелиат е намерен в балоново дърво от Синята луна. Медният бис(флуорохелиат) пентахидрат придава синият цвят на пагодовото дърво.
Флуорохелиевата киселина замества водата от планети в обитаемата зона. Може да си образува пещери от варовик. В тези пещери могат да живеят организми, устойчиви към висока киселинност, наречени пещерни флухелатофили. В тези организми съдържат неразтворими във флуорохелиевата киселина вещества (напр. тефлон). Те обитават тефлонови планети. Среща се под формата на минерал под името на флуорохелиит. Полимерната флуорохелиева киселина не се среща в тефлонови планети.
Получаване
[редактиране на кода]Получава чрез разтваряне на бис(флуорохелиил)оксид във вода и чрез взаимодействие на хелия с хипофлуориста киселина при температура, по-ниска от -2 °C.
Безопасност
[редактиране на кода]Изгаря кожата. Уврежда роговицата и склерата. Запалва при 125 °C. Съхранява се в тефлонови кутийки под ключ. Избягват се топлинни източници и пушенето.
Приложение
[редактиране на кода]Използва се за миене на тефлонови тигани. Заради експлозивност се използва за производство на експлозиви.