Силициев диоксид
За информацията в тази статия или раздел не са посочени източници. Въпросната информация може да е непълна, неточна или изцяло невярна. Имайте предвид, че това може да стане причина за изтриването на цялата статия или раздел. |

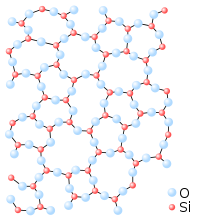
Силициев диоксид (оксид на силиций (IV), SiO2) е химично съединение на силиция – безцветни кристали, с температура на топене tтоп 1713 – 1728 °C, с висока твърдост и якост.
Свойства
[редактиране | редактиране на кода]- Отнася се към групата на киселинните оксиди.
- При нагряване взаимодейства с основни оксиди и алкални основи.
- Разтваря се във флуороводородна киселина.
- SiO2 се отнася към групата на стъклообразуващите оксиди, т.е. склонен е към образуване на преохладена стопилка – стъкло.
- Един от най-добрите диелектрици (не провежда електричен ток).
Полиморфизъм
[редактиране | редактиране на кода]Силициевият диоксид има няколко полиморфни модификации.
Най-разпространената от тях на повърхността на земята е α-кварц, който кристализира в тригоналната сингония.
При нормални условия силициевият диоксид се среща най-често в полиморфната си модификация α-кварц, която преминава обратимо в β-кварц при температура над 573 °C. При по-нататъшно увеличаване на температурата кварцът преминава в тридимит и кристобалит. Тези полиморфни модификации са устойчиви при високи температури и ниски налягания. При високи температури и налягания силициевият диоксид се превръща отначало в коесит, а след това в стишовит (който за първи път е намерен в епицентъра на ядрен взрив). Според някои изследвания стишовитът съставлява значителна част от земната мантия, така че въпросът за това коя разновидност на SiO2 е най-разпространена на Земята, няма еднозначен отговор.
Силициевият диоксид има и аморфна модификация – кварцово стъкло.
Химически свойства
[редактиране | редактиране на кода]Силициевият диоксид SiO2 е киселинен оксид и не реагира с водата.
Устойчив е химически към действието на киселини, но реагира с флуороводородна киселина:
SiO2 + 6HF → H2[SiF6] + 2H2O,
и газообразен флуороводород HF:
SiO2 + 4HF → SiF4↑ + 2H2O.
Тези две реакции се използват широко за разяждане (ецване) на стъклото.
При сплавяне на SiO2 с алкални и основни оксиди, а също така и с карбонати на активни метали се образуват силикати – соли на силициевите киселини, които нямат постоянен състав.
Например, може да се получат:
SiO2 + 4NaOH → (2Na2O)·SiO2 + 2H2O ортосиликат на натрия,
SiO2 + СаО → СаО·SiO2 метасиликат на калция,
Na2CO3 + CaCO3 + 6SiO2 → Na2O·CaO·6SiO2 + 2CO2↑ или смесен силикат на калция и натрия.
От натриев силикат Na2O·CaO·6SiO2 се произвежда стъкло за прозорци.
Трябва да се отбележи, че повечето силикати нямат постоянен състав. От всички силикати само натриевите и калиевите силикати са разтворими във вода.
Основен структурен елемент както на твърдия силициев диоксид, така и на всички силикати е групата [SiO4/2], в която атомът на силиция Si е обкръжен от тетраедър от четири атома кислород О. При това всеки атом кислород е свързан с два атома силиций. Фрагментите [SiO4/2] могат да се свързват един с друг по различен начин. Сред силикатите се различават островни, верижни, лентови, слоести, черупкови и други според характера на връзката на фрагментите [SiO4/2].
Получаване
[редактиране | редактиране на кода]Синтетичен силициев диоксид се получава чрез нагряване на силиций до температура 400 – 500 °C в кислородна атмосфера, при което силицият се окислява до диоксид SiO2.
В лабораторни условия синтетичен силициев диоксид може да бъде получен с реакция между киселини и силикатни соли. Например:
- Na2SiO3 + 2CH3COOH → 2CH3COONa+H2SiO3,
силициевата киселина веднага се разлага на вода и SiO2, който се отлага.
Там, където не е необходима висока чистота на материала, се използва естествен силициев диоксид във вид на пясък.
Приложение
[редактиране | редактиране на кода]Силициевият диоксид се използва в производството на стъкло, керамика, абразиви, бетон, за получаване на силиций, като пълнител в производството на гума, при производството на огнеупорни материали, в хроматографията и др.
Кварцовите кристали притежават пиезоелектрически свойства и се използват в радиотехниката и ултразвуковите апарати.
Силициевият диоксид е главен компонент на почти всички скали и се среща най-често като пясък и кремък.
Изкуствено получени тънки слоеве силициев диоксид се използват като диелектрик при производството на интегрални схеми и други електронни компоненти.
Силициевият диоксид се използва и за производство на оптични кабели.
| Тази страница частично или изцяло представлява превод на страницата „Диоксид кремния“ в Уикипедия на руски. Оригиналният текст, както и този превод, са защитени от Лиценза „Криейтив Комънс – Признание – Споделяне на споделеното“, а за съдържание, създадено преди юни 2009 година – от Лиценза за свободна документация на ГНУ. Прегледайте историята на редакциите на оригиналната страница, както и на преводната страница, за да видите списъка на съавторите.
ВАЖНО: Този шаблон се отнася единствено до авторските права върху съдържанието на статията. Добавянето му не отменя изискването да се посочват конкретни източници на твърденията, които да бъдат благонадеждни. |
