Салицилова киселина
| Салицилова киселина | |||||
| |||||
| Имена | |||||
|---|---|---|---|---|---|
| По IUPAC | 2-хидроксибензоена киселина | ||||
| Свойства | |||||
| Формула | C7H6O3 | ||||
| Моларна маса | 138,122 g·mol−1 | ||||
| Външен вид | безцветни или бели кристали | ||||
| Плътност | 1,443 g/cm3 | ||||
| Точка на топене | 158,6 °C | ||||
| Точка на кипене | 200 °C | ||||
| Сублимация | 76 °C | ||||
| Парно налягане | 10,93 mPa | ||||
| Разтворимост във вода | 2,48 g/L | ||||
| Разтворимост в бензен | 0,775 g/100 g | ||||
| Разтворимост в метанол | 62,48 g/100 g | ||||
| Магнитна възприемчивост | −72,23·10−6 cm3/mol | ||||
| Показател на пречупване | 1,565 | ||||
| Опасности | |||||
| NFPA 704 |
| ||||
| Точка на запалване | 157 °C | ||||
| Точка на самозапалване | 540 °C | ||||
| LD50 | 480 mg/kg (мишки) | ||||
| Идентификатори | |||||
| CAS номер | 69-72-7 | ||||
| PubChem | 338 | ||||
| ChemSpider | 331 | ||||
| Номер на ЕК | 200-712-3 | ||||
| DrugBank | DB00936 | ||||
| KEGG | D00097 | ||||
| MeSH | D020156 | ||||
| ChEBI | 16914 | ||||
| ChEMBL | 424 | ||||
| IUPHAR | 4306 | ||||
| RTECS | VO0525000 | ||||
| ATC | S01BC08 | ||||
| SMILES | c1ccc(c(c1)C(=O)O)O | ||||
| InChI | 1S/C7H6O3/c8-6-4-2-1-3-5(6)7(9)10/h1-4,8H,(H,9,10) 1/C7H6O3/c8-6-4-2-1-3-5(6)7(9)10/h1-4,8H,(H,9,10) | ||||
| InChI ключ | YGSDEFSMJLZEOE-UHFFFAOYSA-N YGSDEFSMJLZEOE-UHFFFAOYAQ | ||||
| UNII | O414PZ4LPZ | ||||
| Gmelin | 3418 | ||||
| Данните са при стандартно състояние на материалите (25 °C, 100 kPa), освен ако не е указано друго. | |||||
| Салицилова киселина в Общомедия | |||||
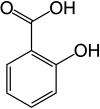
Салициловата киселина е представител на ароматните монохидроксикарбоксилни киселини. Според номенклатурата на IUPAC, тя е 2-хидроксибензоена.[1]
История
[редактиране | редактиране на кода]Салициловата киселина е изолирана за пръв път от кората на бяла върба (Salix alba), откъдето произлиза тривиалното ѝ наименование. От нея северноамериканските индианци са правели лекарства срещу главоболие.
Състав и строеж
[редактиране | редактиране на кода]В салициловата киселина – C6H4(OH)COOH – карбоксилната и хидроксилната групи са директно свързани с бензеновото ядро.
Салициловата киселина е сравнително силна. Една от причините е значителната стабилизация на салицилатния йон чрез образуването на вътрешномолекулна водородна връзка между отрицателно заредения O-атом на карбоксилатния йон с фенолната OH-група. Вътрешномолекулната водородна връзка е много здрава, понеже е в цикъл.
Изомерия
[редактиране | редактиране на кода]Салициловата киселина има три позиционни изомера: орто-, мета- и пара.
Физични свойства
[редактиране | редактиране на кода]Салициловата киселина е безцветно кристално вещество със сладък вкус. Тя се разтваря по-добре в гореща вода, сублимира при слабо нагряване, и декарбоксилира при висока температура.
Химични свойства
[редактиране | редактиране на кода]Наличието на две функционални групи (-COOH и -OH), бензеново ядро, както и взаимното им влияние, определят химичните свойства на салициловата киселина и нейната висока реакционноспособност.
Киселинните свойства на салициловата киселина се определят както от карбоксилната, така и от хидроксилната група. Тя взаимодейства с метали, основни оксиди и хидроксиди, като реакциите протичат на два етапа (първо с -COOH групата, а после с -OH групата).
Естерификация
[редактиране | редактиране на кода]Естерификацията с алкохоли протича само с карбоксилната група. Фенолната хидроксилна група се естерифицира с оцетен анхидрид. Солите и естерите на салициловата киселина се наричат салицилати и намират широко приложение.
При естерификация на салицилова киселина с оцетна киселина се получава ацетилсалицилова киселина (аспирин).
Получаване
[редактиране | редактиране на кода]Един от важните промишлени методи за получаване на салицилова киселина е методът на Колбе – взаимодействие между сух натриев фенолат и CO2 под налягане (P) и при температура 120°-140 °C. Полученият натриев салицилат се обработва със солна киселина, при което се отделя натриев хлорид и се получава салицилова киселина.
Физиологично действие и приложение
[редактиране | редактиране на кода]Салициловата киселина има антисептични и бактерицидни свойства, предотвратява протичането на гнилостни процеси и затова се използва като консервант в хранителната промишленост и в домакинството. Нейните производни – естери, соли и други, намират широко приложение в медицината. Особено голямо е приложението на ацетилсалициловата киселина (известна още като аспирин) и фенилсалицилата (лекарството салол).