Винена киселина
| Винена киселина | |
|---|---|
 |
 |
| Обща информация | |
| Наименование по IUPAC | 2,3-dihydroxybutanedioic acid |
| Други имена | 2,3-дихидрокси сукцинат раценична киселина паратартарова киселина |
| Молекулна формула | C4H6O6 |
| SMILES | ? |
| 3D структура | тук |
| Моларна маса | 150,087 g/mol |
| Външен вид | бял прах |
| CAS номер | 526-83-0 |
| Свойства | |
| Плътност и фаза | 1,79 g/mL |
| Разтворимост във вода | 133 g/100 ml (20 °C) |
| Точка на топене | 171 – 174 °C (L-тартарат) 206 °C (DL) |
| Точка на кипене | |
| Освен където е обявено друго, данните са дадени за материали в стандартно състояние (при 25 °C, 100 kPa) Права и справки | |
Винената или тартаровата киселина е двуосновна органична киселина, вид захарна киселина. Представлява бели кристали или прах. Съдържа се естествено в много растения, особено в грозде и тамаринд, и е една от основните киселини във виното под формата на калиева сол (винен камък). Ползва се като добавка към други храни, като им придава кисел вкус, а освен това е и антиоксидант. Солите ѝ се наричат тартарати. Тартаровата киселина може да се разглежда като дихидроксилно производно на янтарната киселина. Винената киселина (неправилно наречена лимонтузу) е подправка към плодови сокове, лимонада и е основна съставна част на бакпулвера.
За пръв път тартаровата киселина е изолирана от калиев тартарат, известен от древността като винен камък (още тригия, тартар). Откритието е направено около 800 г. от персийския алхимик Джабир ибн Хаян (Jabir ibn Hayyan), който е откривател и на други основни химични процеси, използвани и в наши дни.[1] Съвременният процес на изолиране е разработен през 1769 г. от шведския химик Карл Вилхелм Шееле. Калиево-натриевият тартарат (сегнетова сол) се използва за приготвяне на Фелингов разтвор (прясно утаен меден дихидроксид – Cu(OH)2).
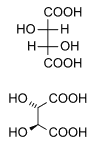
Хиралността (оптичната изомерия) на винената киселина е открита през 1832 г. от Жан Батист Био, който наблюдавал способността ѝ да завърта равнината на поляризирана светлина. Луи Пастьор продължава неговите изследвания през 1847 г., като проучва формата на кристалите на винената киселина и установява, че са асиметрични. Чрез ръчно пречистване на кристалите с различна форма Пастьор първи получава чиста проба от L(+)-винена киселина[2][3][4][5].
Стереометрия
[редактиране | редактиране на кода]
Естествено съществуващата тартарова киселина е хирална. Това означава, че има две молекули, които са огледални форми, но не са идентични. Природните форми на тартаровата киселина са L-(+)-тартарова киселина или декстротартарова киселина acid. Огледалната ѝ форма (нейният енантиомер) е левотартарова киселина или D-(−)-тартарова киселина и ахирална форма, мезотартарова киселина, създадена изкуствено. Важно е да се отбележи, че представките декстро и лево не са свързани с D/L конфигурацията (която отразява структурната [6] им връзката с D- или L-глицералдехида), а е показател за оптичната им активност, (+) = декстро, (−) = лево. Левотартаровата и декстротартавовата киселина са енантиомери, докато мезотартаровата е техен диастереомер.[7][8]
Съществува рядко срещана оптично неактивна форма на тартаровата киселина, DL-тартарова киселина, която е смес 1:1 от лево и декстро форма. Тя се различава от мезотартаровата и е наречена рацемична киселина (от латински език racemus – „чепка грозде“). Рацемична смес днес се използва като термин, обозначаващ смес от енантиомери в отношение 1:1.
| левотартарова киселина (D-(−)-тартарова киселина) |
декстротартарова киселина (L-(+)-тартарова киселина) |
мезотартарова киселина |
|---|---|---|

|

| |
|
DL-тартарова киселина (рацемична киселина) |
||
Производни
[редактиране | редактиране на кода]

Тартаровата киселина е важна суровина в органичната химия за синтезата на други хирални молекули. Важни нейни производни са солите ѝ: калиев хидроген тартарат (винен камък), сегнетова сол (калиево-натриев тартарат), калиев тартарат в медицината като еметик (средство, предизвикващо повръщане). Диизопропил тартаратът се използва за катализатор при асиметрична синтеза.
Тартаровата киселина е мускулен токсин, като потиска продукцията на малат (метаболит от цикъла на Кребс). Високите дози могат да предизвикат парализа и дори смърт.[9] Леталната доза за 50% смъртност (LD50) е около 7,5 g/kg за човек, ~5,3 g/kg за зайци и ~4,4 g/kg за мишки.[10] От тези данни може да се заключи, че за да се убие възрастен 70-килограмов човек, е необходимо количество от 500 g тартарат, така че тази сол може спокойно да се употребява като добавка към храните. Като хранителна добавка тартаровата киселина за използва като антиоксидант и се означава като E334.
Тартаратът във виното
[редактиране | редактиране на кода]
Тартаровата киселина може да се разпознае веднага от познавачите на вино по „винените диаманти“, кристалчетата, които спонтанно образува по корковата тапа. Тези тартарати са безопасни, макар че понякога се приемат за стъкълца.
Тартаровата киселина играе важна роля, понижавайки pH на ферментиращата винена мъст до нива, при които много от нежеланите зловредни бактерии не могат да се развиват, а по-късно действа и като естествен консервант. В устата тартаратът придава онзи тръпчив вкус на виното, макар че роля имат и лимонената и ябълчената киселина.
Източници
[редактиране | редактиране на кода]- ↑ Lisa Solieri, Paolo Giudici. Vinegars of the World. Springer, 2009. ISBN 8847008654. с. 29.
- ↑ L. Pasteur (1848) „Mémoire sur la relation qui peut exister entre la forme cristalline et la composition chimique, et sur la cause de la polarisation rotatoire“ (Memoir on the relationship which can exist between crystalline form and chemical composition, and on the cause of rotary polarization)", Comptes rendus de l'Académie des sciences (Paris), vol. 26, pages 535 – 538.
- ↑ L. Pasteur (1848) „Sur les relations qui peuvent exister entre la forme cristalline, la composition chimique et le sens de la polarisation rotatoire“ (On the relations that can exist between crystalline form, and chemical composition, and the sense of rotary polarization), Annales de Chimie et de Physique, 3rd series, vol. 24, no. 6, pages 442 – 459.
- ↑ George B. Kauffman and Robin D. Myers (1998) Pasteur's resolution of racemic acid: A sesquicentennial retrospect and a new translation, The Chemical Educator, vol. 3, no. 6, pages (?).
- ↑ H. D. Flack (2009) Louis Pasteur's discovery of molecular chirality and spontaneous resolution in 1848, together with a complete review of his crystallographic and chemical work, Архив на оригинала от 2012-09-06 в Archive-It Acta Crystallographica, Section A, vol. 65, pages 371 – 389.
- ↑ J. M. McBride's Yale lecture on history of stereochemistry of tartaric acid, the D/L and R/S systems // Архивиран от оригинала на 2014-11-29. Посетен на 2014-07-03.
- ↑ various. Organic Chemistry. Global Media, 23 юли 2007. ISBN 9788189940768. с. 65. Посетен на 5 юни 2010.[неработеща препратка]
- ↑ (WO/2008/022994) Use of azabicyclo hexane derivatives[неработеща препратка]
- ↑ Alfred Swaine Taylor, Edward Hartshorne. Medical jurisprudence. Blanchard and Lea, 1861. с. 61.
- ↑ Joseph A. Maga, Anthony T. Tu. Food additive toxicology. CRC Press, 1995. ISBN 0824792459. с. 137 – 138.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||