Амониев метаванадат
| Амониев метаванадат | |||||
| |||||
| Имена | |||||
|---|---|---|---|---|---|
| По IUPAC | Амониев триоксованадат(V) | ||||
| Други | Амониев ванадат Ammonium vanadicum | ||||
| Свойства | |||||
| Формула | NH4VO3 | ||||
| Моларна маса | 116.98 g/mol | ||||
| Външен вид | безцветни или слабожълтеникави кристали | ||||
| Плътност | 2.326 g/cm3 | ||||
| Точка на топене | 200ºС (разлагане) | ||||
| Точка на кипене | разлагане | ||||
| Разтворимост във вода | 4.8 g/1000 ml (20 °C) | ||||
| Разтворимост в диетаноламин | добра | ||||
| Разтворимост в етаноламин | добра | ||||
| Опасности | |||||
| ЕС класификация | 232-261-3 | ||||
| Основни опасности | възможен мутаген, | ||||
| NFPA 704 |
| ||||
| Точка на запалване | незапалим | ||||
| LD50 | 58.1 mg/kg, орално (плъх) | ||||
| Сродни съединения | |||||
| Сродни аниони | |||||
| Сродни катиони | |||||
| Други | |||||
| Идентификатори | |||||
| CAS номер | 7803-55-6 | ||||
| PubChem | 516859 | ||||
| ChemSpider | 19968892 | ||||
| RTECS | YWD875000 | ||||
| SMILES | [NH4+].O=[V-](=O)=O | ||||
| InChI | 1S/H3N.3O.V/h1H3;;;;/q;;;;-1/p+1 1/H3N.3O.V/h1H3;;;;/q;;;;- 1/p+1/rH3N.O3V/c;1-4(2)3/h1H3;/q;-1/p+1 | ||||
| InChI ключ | UXJVWJGDHIZPLD-UHFFFAOYSA-O UXJVWJGDHIZPLD-KKTKNITLAZ | ||||
| UNII | FL85PX638G | ||||
| Данните са при стандартно състояние на материалите (25 °C, 100 kPa), освен ако не е указано друго. | |||||
| Амониев метаванадат в Общомедия | |||||
Амониевият метаванадат е органично съединение с формула NH4VO3. Представлява безцветни или слабожълтеникави кристали. Той е важен междинен компонент в пречистването на ванадия.[1]
Синтез и структура
[редактиране | редактиране на кода]Съединението може да се приготви с добавяне на амониеви соли в разтвори на ванадати, генериран от разпадане на V2O5 в основа. Съединението представлява безцветни кристали.[2][3]
Приема полимерна форма във вид на вериги [VO3]-, образувани като ъглообразни VO4 тетраедри. Тези вериги са свързани помежду си посредством водородни връзки с амониеви йони.[4]
 |
 |
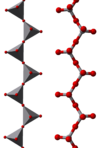
|
| модел топки и пръчки | полиедричен модел | [(VO3)n]n− вериги |
Свойства
[редактиране | редактиране на кода]Водният му разтвор бързо пожълтява. При загряване във вакуум още при 135ºС започва, а при 210ºС напълно се разлага до низши ванадиеви оксиди, като отделя амоняк. При нагряване на въздуха се превръща в V2O5 – анхидрид на HVO3 – метаванадиевата киселина.
Безопасност
[редактиране | редактиране на кода]Амониевият метаванадат е отровен. Действа върху централната нервна система, засяга тънките черва, предизвиква кръвоизливи, парализи и др.
Приложение
[редактиране | редактиране на кода]Ванадият е често пречистен от водни екстракти от шлака и руда чрез селективна преципитация на амониев метаванадат. Материалът е нагряван до получаване на диванадиев пентаоксид:[1]
- 2 NH4VO3 → V2O5 + 2 NH3 + H2O
Той се използва за производството на печатарски мастила и др.
Други
[редактиране | редактиране на кода]Ванадатите може да представят като структурна мимика на фосфатите и в този случай проявяват биологични свойства.[5][6]
Амониевият метаванадат се използва за приготвяне на реагент на Манделин, качествен алкалоиден тест.
Източници
[редактиране | редактиране на кода]- ↑ а б Günter Bauer, Volker Güther, Hans Hess, Andreas Otto, Oskar Roidl, Heinz Roller, Siegfried Sattelberger „Vanadium and Vanadium Compounds“ in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a27_367
- ↑ G. Brauer „Ammonium Metavanadate“ in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 1272.
- ↑ Robert H. Baker, Harry Zimmerman, R. N. Maxson „Ammonium Metavanadate“ Inorganic Syntheses, 1950, Vol. 3, 117 – 118. DOI:10.1002/9780470132340.ch30
- ↑ Vladimír Syneček and František Hanic. The crystal structure of ammonium metavanadate // Czechoslovak Journal of Physics 4 (2). 1954. DOI:10.1007/BF01687750. с. 120 – 129.
- ↑ Korbecki, Jan; Baranowska-Bosiacka, Irena; Gutowska, Izabela; Chlubek, Dariusz „Biochemical and medical importance of vanadium compounds“ Acta Biochimica Polonica 2012, vol. 59, pp. 195 – 200.
- ↑ Crans, D. C.; Chatterjee, P. B. „Vanadium biochemistry“ Reedijk, Jan; Poeppelmeier, Kenneth, Eds. Comprehensive Inorganic Chemistry II (2013), 3, 323 – 342. DOI:10.1016/B978-0-08-097774-4.00324-7



